- ATMOSPHÈRE (chimie)
- ATMOSPHÈRE (chimie)Le point de départ obligé de la chimie de l’atmosphère terrestre est la dissociation de la molécule d’oxygène, par absorption de la radiation ultraviolette du Soleil, suivie de la formation immédiate de la molécule d’ozone, dans l’air pur et sec constitué essentiellement de 78 p. 100 d’azote, 21 p. 100 d’oxygène et 1 p. 100 d’argon.La chimie atmosphérique présente cependant des aspects différents dans les diverses régions de l’homosphère (au-dessous de 100 km) caractérisée par le maintien d’une proportion constante de ses éléments principaux, l’azote et l’oxygène moléculaires. Par suite de leurs constitutions différentes en gaz minoritaires tels que les composés hydrogénés, azotés ou halogénés, les trois régions de l’homosphère, c’est-à-dire la troposphère (tropopause de 9 km aux pôles à 17 km à l’équateur), la stratosphère (stratopause vers 50 km) et la mésosphère (mésopause vers 85 km), se différencient par des caractères chimiques propres qui doivent être étudiés séparément. Ainsi, au niveau du sol, la chimie de la troposphère n’a pas de caractère homogène par suite de la diversité de produits secondaires et d’effets localisés liés à divers types de pollution.GénéralitésIl convient tout d’abord de séparer l’action de la radiation solaire ultraviolette en deux domaines distincts correspondant respectivement à la photodissociation et à la photo-ionisation des constituants de l’atmosphère. Le domaine spectral de longueurs d’onde inférieures à 100 nm est lié à l’ionisation de l’oxygène et de l’azote et est à la base de la formation de l’ionosphère. De plus, tout ce rayonnement ultraviolet est absorbé au-dessus de 100 km et conduit à la formation des régions E et F de l’ionosphère. Toutefois, les rayons X de longueurs d’onde inférieures à 1 nm participent à l’ionisation de la région D au-dessous de 100 km en même temps que la radiation Lyman 見 à 121,56 nm, qui ionise le monoxyde d’azote, NO, dans la mésosphère.Le domaine spectral de longueurs d’onde supérieures à 100 nm intervient dans le phénomène de la photodissociation. Seule la molécule d’oxygène peut être dissociée par la radiation ultraviolette de longueurs d’onde inférieures à 242 nm, alors que l’azote n’est soumis à aucun effet de photodissociation (c’est un gaz inerte dans les conditions normales de la chimie homosphérique). En outre, les propriétés d’absorption de la molécule d’oxygène induisent, au-dessus de 100 km, dans la thermosphère, une forte photodissociation qui conduit à la dissociation définitive de 2 en atomes d’oxygène, O. Cependant, l’essentiel de la photodissociation de 2 apparaît d’abord dans la mésosphère, au-dessous de 85 km, non seulement par une absorption de la radiation solaire Lyman 見, mais surtout par une absorption, dans le domaine spectral situé entre 200 et 175 nm, du système de bandes de 2 appelé les bandes de Schumann-Runge. L’autre part de la photodissociation de 2 est réservée à la stratosphère, au-dessous de 50 km, par une absorption continue appelée le continuum de Herzberg, situé entre 200 et 240 nm. L’apparition de l’atome d’oxygène dans la mésosphère et dans la stratosphère conduit automatiquement à son association avec une molécule d’oxygène en vue de constituer une molécule d’ozone.La molécule d’ozone jouit de propriétés absorbantes, très importantes pour le développement de la chimie atmosphérique, dans deux domaines spectraux qui furent identifiés respectivement par James Chappuis en 1880 dans le domaine visible (bandes de Chappuis) et par Ralph W. L. Hartley en 1881 dans l’ultraviolet (bandes de Hartley). Les bandes de Hartley s’étendent vers les courtes longueurs d’onde au-delà de 240 nm, allant ainsi jusqu’à recouvrir le domaine d’absorption de la molécule d’oxygène dans le continuum de Herzberg. Du côté des grandes longueurs d’onde, ces bandes sont prolongées au-delà de 310 nm par les bandes dites de Huggins. L’ozone limite ainsi, par son spectre d’absorption ultraviolet, la pénétration de radiations solaires abiotiques.Enfin, il convient de souligner que, à la suite de cette forte absorption qui apparaît dans la stratosphère, la troposphère n’est pratiquement pas soumise à des effets de photodissociation directe et, dès lors, la chimie troposphérique dépend essentiellement de réactions secondaires qui résultent de la photodissociation de l’ozone existant dans la troposphère.Atmosphère pure et sècheOn sait depuis plus d’un siècle que l’air pur et sec soumis à une décharge électrique produit de l’ozone par dissociation de l’oxygène. Dans l’atmosphère, le même phénomène apparaît sous l’effet du rayonnement ultraviolet solaire (fig. 1). On a successivement la photodissociation de 2 (coefficient J2), la reformation possible de O2 (coefficient k 1) à haute altitude, au-delà de 70 km, la formation de l’ozone (coefficient k 2), la photodissociation de 3 (coefficient J3) et, en fin de compte, la réaction entre 3 et O (coefficient k 3):
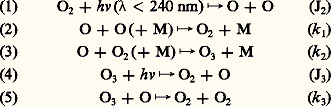 Dans ces équations, M est la troisième particule (N2 ou 2) donnant lieu à une collision triple requise pour capter l’énergie de dissociation de la molécule formée. Les conditions atmosphériques et les valeurs numériques attachées aux constantes de réaction et déterminées au laboratoire indiquent que le maximum de photodissociation de l’oxygène apparaît dans la stratosphère et conduit à un maximum de concentration de l’ozone également dans la stratosphère, à quelque 25 km d’altitude. Les études détaillées montrent que l’ozone est en équilibre photochimique dans le domaine atmosphérique situé au-dessus de son maximum de concentration. En d’autres termes, la production d’ozone sous l’effet de l’ultraviolet solaire est automatiquement compensée par la reformation de molécules d’oxygène.On avait cependant déjà découvert, il y a plus d’un demi-siècle, que l’ozone ne se conformait pas aux variations du rayonnement solaire liées à la latitude ou à la saison. Ce comportement propre à l’ozone, avec maximum au printemps et minimum en automne et également avec une abondance supérieure aux hautes latitudes à celle des basses latitudes, a démontré que les réactions chimiques étaient lentes par rapport au transport atmosphérique dans la basse stratosphère, au-dessous de 25 km.Ainsi, dans le cadre des études de chimie atmosphérique, il faut toujours associer les mouvements de l’atmosphère (transports verticaux et horizontaux) aux conditions qui régissent les réactions chimiques ne conduisant pas spontanément à l’équilibre photochimique (fig. 2). Si ces conditions s’appliquent à l’ozone dans la stratosphère inférieure, elles sont du même type pour l’atome d’oxygène dans la mésosphère supérieure, au-delà de 75 km. En effet, l’équation (3) indique que, par suite de la diminution de la concentration de 2 et de 2 quand l’altitude augmente, la formation de 3 devient de moins en moins importante. À partir de 60 km, la concentration de l’atome d’oxygène l’emporte sur celle de l’ozone. Néanmoins, cet atome est encore en équilibre photochimique jusqu’à 70 km, mais, au niveau de la mésopause (85 km), il est soumis aux mouvements atmosphériques et sa concentration locale dépend plus des conditions de transport que de celles de sa production.Lorsqu’on effectue la comparaison des valeurs des concentrations théoriques et observées de l’ozone dans la stratosphère, on constate que les valeurs théoriques sont supérieures aux valeurs observées. Cette différence est due à l’effet de réactions qui n’apparaissent pas dans l’oxygène pur mais existent dans l’atmosphère réelle où de nombreux constituants minoritaires sont, en effet, présents.Action des constituants minoritairesDes études expérimentales montrent que l’ozone peut être réduit par l’action d’un cycle catalytique du type suivant:
Dans ces équations, M est la troisième particule (N2 ou 2) donnant lieu à une collision triple requise pour capter l’énergie de dissociation de la molécule formée. Les conditions atmosphériques et les valeurs numériques attachées aux constantes de réaction et déterminées au laboratoire indiquent que le maximum de photodissociation de l’oxygène apparaît dans la stratosphère et conduit à un maximum de concentration de l’ozone également dans la stratosphère, à quelque 25 km d’altitude. Les études détaillées montrent que l’ozone est en équilibre photochimique dans le domaine atmosphérique situé au-dessus de son maximum de concentration. En d’autres termes, la production d’ozone sous l’effet de l’ultraviolet solaire est automatiquement compensée par la reformation de molécules d’oxygène.On avait cependant déjà découvert, il y a plus d’un demi-siècle, que l’ozone ne se conformait pas aux variations du rayonnement solaire liées à la latitude ou à la saison. Ce comportement propre à l’ozone, avec maximum au printemps et minimum en automne et également avec une abondance supérieure aux hautes latitudes à celle des basses latitudes, a démontré que les réactions chimiques étaient lentes par rapport au transport atmosphérique dans la basse stratosphère, au-dessous de 25 km.Ainsi, dans le cadre des études de chimie atmosphérique, il faut toujours associer les mouvements de l’atmosphère (transports verticaux et horizontaux) aux conditions qui régissent les réactions chimiques ne conduisant pas spontanément à l’équilibre photochimique (fig. 2). Si ces conditions s’appliquent à l’ozone dans la stratosphère inférieure, elles sont du même type pour l’atome d’oxygène dans la mésosphère supérieure, au-delà de 75 km. En effet, l’équation (3) indique que, par suite de la diminution de la concentration de 2 et de 2 quand l’altitude augmente, la formation de 3 devient de moins en moins importante. À partir de 60 km, la concentration de l’atome d’oxygène l’emporte sur celle de l’ozone. Néanmoins, cet atome est encore en équilibre photochimique jusqu’à 70 km, mais, au niveau de la mésopause (85 km), il est soumis aux mouvements atmosphériques et sa concentration locale dépend plus des conditions de transport que de celles de sa production.Lorsqu’on effectue la comparaison des valeurs des concentrations théoriques et observées de l’ozone dans la stratosphère, on constate que les valeurs théoriques sont supérieures aux valeurs observées. Cette différence est due à l’effet de réactions qui n’apparaissent pas dans l’oxygène pur mais existent dans l’atmosphère réelle où de nombreux constituants minoritaires sont, en effet, présents.Action des constituants minoritairesDes études expérimentales montrent que l’ozone peut être réduit par l’action d’un cycle catalytique du type suivant: X désigne un atome ou une molécule comme l’hydrogène, le monoxyde d’azote ou des radicaux hydroxyle ou perhydroxyle, ou même des atomes halogénés. Ainsi, à la réaction (5) de reformation de 2 s’ajoute l’action des réactions de l’ensemble catalytique (6). En d’autres termes, les atomes halogénés, ou tout autre constituant du même type attaquant l’ozone, sont toujours restitués par la réaction de leur oxyde avec l’atome d’oxygène et constituent ainsi un cycle permanent de destruction de l’ozone. En chimie atmosphérique, il s’agit donc de déterminer comment apparaissent de tels constituants et en même temps de fixer leur importance.On a d’abord reconnu l’existence atmosphérique de la vapeur d’eau, H2O, du méthane, CH4, et de l’hydrogène moléculaire, H2, jusqu’à de hauts niveaux. Dans la mésosphère, on assiste à la photodissociation de H2O et de CH4 par des processus tels que:
X désigne un atome ou une molécule comme l’hydrogène, le monoxyde d’azote ou des radicaux hydroxyle ou perhydroxyle, ou même des atomes halogénés. Ainsi, à la réaction (5) de reformation de 2 s’ajoute l’action des réactions de l’ensemble catalytique (6). En d’autres termes, les atomes halogénés, ou tout autre constituant du même type attaquant l’ozone, sont toujours restitués par la réaction de leur oxyde avec l’atome d’oxygène et constituent ainsi un cycle permanent de destruction de l’ozone. En chimie atmosphérique, il s’agit donc de déterminer comment apparaissent de tels constituants et en même temps de fixer leur importance.On a d’abord reconnu l’existence atmosphérique de la vapeur d’eau, H2O, du méthane, CH4, et de l’hydrogène moléculaire, H2, jusqu’à de hauts niveaux. Dans la mésosphère, on assiste à la photodissociation de H2O et de CH4 par des processus tels que: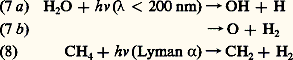 Ces processus donnent lieu à l’apparition de l’atome d’hydrogène et de l’hydroxyle. Cependant, dans la stratosphère, où la photodissociation de H2O n’apparaît pas, on doit faire appel à un autre processus dont l’ozone est responsable. Il s’agit d’un mécanisme de dissociation due à la réaction avec l’atome d’oxygène excité O(1D). On observe la production de H et de OH:
Ces processus donnent lieu à l’apparition de l’atome d’hydrogène et de l’hydroxyle. Cependant, dans la stratosphère, où la photodissociation de H2O n’apparaît pas, on doit faire appel à un autre processus dont l’ozone est responsable. Il s’agit d’un mécanisme de dissociation due à la réaction avec l’atome d’oxygène excité O(1D). On observe la production de H et de OH: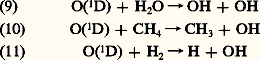 L’origine de cet atome d’oxygène excité est due à l’ozone. Sa concentration maximum dans la stratosphère ne s’élève qu’à quelque cent ou deux cents atomes par centimètre cube en présence de 1018 molécules 2 et 2. Sous l’influence de l’absorption dans la bande de Hartley pour des longueurs d’onde inférieures à 310 nm, on a en effet la production d’une molécule et d’un atome d’oxygène dans des états excités:
L’origine de cet atome d’oxygène excité est due à l’ozone. Sa concentration maximum dans la stratosphère ne s’élève qu’à quelque cent ou deux cents atomes par centimètre cube en présence de 1018 molécules 2 et 2. Sous l’influence de l’absorption dans la bande de Hartley pour des longueurs d’onde inférieures à 310 nm, on a en effet la production d’une molécule et d’un atome d’oxygène dans des états excités: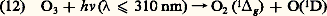 L’état excité O(1D) permet avec son énergie supplémentaire les réactions rapides (9), (10) et (11) qui n’auraient pas lieu avec l’atome O(3P) dans son état normal, tout au moins aux températures de l’atmosphère.Il faut en outre déterminer la nature des autres constituants qui peuvent participer à un tel processus de dissociation. Un autre cas important est celui qui conduit à la production de l’oxyde d’azote, NO, à partir de l’hémioxyde d’azote 2O:
L’état excité O(1D) permet avec son énergie supplémentaire les réactions rapides (9), (10) et (11) qui n’auraient pas lieu avec l’atome O(3P) dans son état normal, tout au moins aux températures de l’atmosphère.Il faut en outre déterminer la nature des autres constituants qui peuvent participer à un tel processus de dissociation. Un autre cas important est celui qui conduit à la production de l’oxyde d’azote, NO, à partir de l’hémioxyde d’azote 2O: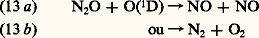 En fin de compte, il faut connaître l’abondance atmosphérique de ces constituants minoritaires comme H2O, 2O, etc.Les constituants hydrogénés et la chimie mésosphériqueIl y a quelque trente ans que l’on sait combien la chimie de la stratosphère dépend des réactions qui apparaissent dans une atmosphère d’oxygène et d’hydrogène. La présence de l’atome d’hydrogène donne lieu aux réactions:
En fin de compte, il faut connaître l’abondance atmosphérique de ces constituants minoritaires comme H2O, 2O, etc.Les constituants hydrogénés et la chimie mésosphériqueIl y a quelque trente ans que l’on sait combien la chimie de la stratosphère dépend des réactions qui apparaissent dans une atmosphère d’oxygène et d’hydrogène. La présence de l’atome d’hydrogène donne lieu aux réactions: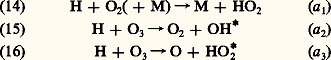 Le processus (15) a été reconnu comme une réaction d’une extrême importance, car elle donne lieu à une molécule OH excitée qui retourne à son état normal par une suite d’émissions infrarouges vers 1 猪. Celles-ci sont de loin les plus fortes émissions de la lueur nocturne et sont ainsi dues à la réaction de l’ozone avec l’atome d’hydrogène issu de la photodissociation de la vapeur d’eau. L’apparition de H et de OH conduit à partir de (15) au cycle catalytique:
Le processus (15) a été reconnu comme une réaction d’une extrême importance, car elle donne lieu à une molécule OH excitée qui retourne à son état normal par une suite d’émissions infrarouges vers 1 猪. Celles-ci sont de loin les plus fortes émissions de la lueur nocturne et sont ainsi dues à la réaction de l’ozone avec l’atome d’hydrogène issu de la photodissociation de la vapeur d’eau. L’apparition de H et de OH conduit à partir de (15) au cycle catalytique: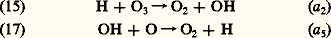 On observe de même une réaction analogue à (17):
On observe de même une réaction analogue à (17):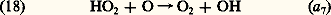 Cette réaction, associée à (17) et à (14), constitue également une attaque continuelle de l’ozone atmosphérique. Dans la mésosphère, on doit ajouter la réaction de H avec H2:
Cette réaction, associée à (17) et à (14), constitue également une attaque continuelle de l’ozone atmosphérique. Dans la mésosphère, on doit ajouter la réaction de H avec H2: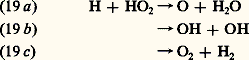 Cette dernière réaction conduit à une formation importante d’hydrogène moléculaire, H2, dans la mésosphère.En fin de compte, l’hydrogène atomique et moléculaire, gaz très léger issu de la vapeur d’eau atmosphérique dans la mésosphère, est soumis par diffusion verticale à un transport vers les régions supérieures de l’atmosphère et constitue la couronne d’hydrogène terrestre, d’où il s’échappe continuellement vers l’espace interplanétaire.La chimie mésosphérique comprend d’autres éléments; on peut cependant considérer pratiquement qu’elle se résume à une interaction entre les composés de l’oxygène, 2, O et 3 et les composés de l’hydrogène, l’atome et la molécule avec les hydroxyles et perhydroxyles.Les composés oxygénés de l’azote et la chimie stratosphériqueL’importance des oxydes d’azote se manifeste par le cycle catalytique entre le monoxyde, NO, et le dioxyde, 2:
Cette dernière réaction conduit à une formation importante d’hydrogène moléculaire, H2, dans la mésosphère.En fin de compte, l’hydrogène atomique et moléculaire, gaz très léger issu de la vapeur d’eau atmosphérique dans la mésosphère, est soumis par diffusion verticale à un transport vers les régions supérieures de l’atmosphère et constitue la couronne d’hydrogène terrestre, d’où il s’échappe continuellement vers l’espace interplanétaire.La chimie mésosphérique comprend d’autres éléments; on peut cependant considérer pratiquement qu’elle se résume à une interaction entre les composés de l’oxygène, 2, O et 3 et les composés de l’hydrogène, l’atome et la molécule avec les hydroxyles et perhydroxyles.Les composés oxygénés de l’azote et la chimie stratosphériqueL’importance des oxydes d’azote se manifeste par le cycle catalytique entre le monoxyde, NO, et le dioxyde, 2: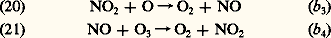 Ce cycle conduirait à une destruction considérable de l’ozone s’il n’était tempéré par la photodissociation de 2 dans le champ de radiation du soleil. On a en effet, sous l’influence du rayonnement de longueurs d’onde inférieures à 400 nm, une photodissociation très rapide qui limite la concentration du dioxyde d’azote:
Ce cycle conduirait à une destruction considérable de l’ozone s’il n’était tempéré par la photodissociation de 2 dans le champ de radiation du soleil. On a en effet, sous l’influence du rayonnement de longueurs d’onde inférieures à 400 nm, une photodissociation très rapide qui limite la concentration du dioxyde d’azote: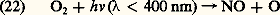 C’est en quelque sorte une production d’ozone par la présence de l’atome d’oxygène qui peut s’associer avec 2 pour former 3.La concentration de NO et de 2 dans la stratosphère résultant d’une production continuelle à partir de 2O (équation 13a ) est cependant limitée par d’autres réactions. Nous retiendrons surtout celle qui donne lieu à la formation de l’acide nitrique par le mécanisme:
C’est en quelque sorte une production d’ozone par la présence de l’atome d’oxygène qui peut s’associer avec 2 pour former 3.La concentration de NO et de 2 dans la stratosphère résultant d’une production continuelle à partir de 2O (équation 13a ) est cependant limitée par d’autres réactions. Nous retiendrons surtout celle qui donne lieu à la formation de l’acide nitrique par le mécanisme: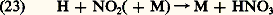 La molécule d’acide nitrique, qui subit également diverses réactions et est soumise à la photodissociation, subsiste néanmoins et devient le composé oxygéné de l’azote le plus important dans la stratosphère. Son accumulation ne peut pourtant persister car l’acide nitrique traverse la tropopause et passe dans la troposphère où il disparaît rapidement, car il est soluble dans l’eau. Ainsi, si l’hémioxyde d’azote est la source des oxydes d’azote dans la stratosphère, l’acide nitrique est le puits qui s’oppose à leur accumulation au-delà d’une certaine limite. Mais on reconnaît maintenant que l’action du cycle des réactions (20), (21) et (22) conduit à une réduction de la concentration d’ozone stratosphérique par rapport à une atmosphère d’oxygène pur.Finalement, il faut tenir compte d’une interaction entre l’hydroperoxyle et le monoxyde d’azote. En effet, la réaction
La molécule d’acide nitrique, qui subit également diverses réactions et est soumise à la photodissociation, subsiste néanmoins et devient le composé oxygéné de l’azote le plus important dans la stratosphère. Son accumulation ne peut pourtant persister car l’acide nitrique traverse la tropopause et passe dans la troposphère où il disparaît rapidement, car il est soluble dans l’eau. Ainsi, si l’hémioxyde d’azote est la source des oxydes d’azote dans la stratosphère, l’acide nitrique est le puits qui s’oppose à leur accumulation au-delà d’une certaine limite. Mais on reconnaît maintenant que l’action du cycle des réactions (20), (21) et (22) conduit à une réduction de la concentration d’ozone stratosphérique par rapport à une atmosphère d’oxygène pur.Finalement, il faut tenir compte d’une interaction entre l’hydroperoxyle et le monoxyde d’azote. En effet, la réaction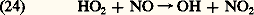 restitue non seulement l’hydroxyle, mais donne lieu également au dioxyde d’azote qui, par photodissociation presque immédiate, libère un atome d’oxygène qui donne lieu à la formation d’ozone. Cette dernière réaction joue un rôle important dans la stratosphère inférieure, où la photodissociation de l’oxygène moléculaire a perdu son importance.Les composés halogénés et la chimie stratosphériqueLa famille des halogènes n’a été introduite que tout récemment en chimie atmosphérique. Il s’agit du fluor, du chlore, du brome et de l’iode. On peut appliquer le cycle catalytique (6) avec un atome tel que le chlore, Cl, en présence de son monoxyde, ClO. On a, en effet:
restitue non seulement l’hydroxyle, mais donne lieu également au dioxyde d’azote qui, par photodissociation presque immédiate, libère un atome d’oxygène qui donne lieu à la formation d’ozone. Cette dernière réaction joue un rôle important dans la stratosphère inférieure, où la photodissociation de l’oxygène moléculaire a perdu son importance.Les composés halogénés et la chimie stratosphériqueLa famille des halogènes n’a été introduite que tout récemment en chimie atmosphérique. Il s’agit du fluor, du chlore, du brome et de l’iode. On peut appliquer le cycle catalytique (6) avec un atome tel que le chlore, Cl, en présence de son monoxyde, ClO. On a, en effet: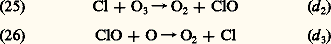 Il convient cependant d’introduire les interactions possibles. On note tout d’abord que l’action du monoxyde d’azote restitue Cl et limite donc l’importance absolue du cycle de réactions (25) et (26):
Il convient cependant d’introduire les interactions possibles. On note tout d’abord que l’action du monoxyde d’azote restitue Cl et limite donc l’importance absolue du cycle de réactions (25) et (26):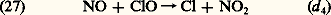 Cette action se double en même temps de la formation de 2 qui donne lieu, comme nous l’avons déjà signalé, à la restitution d’atomes d’oxygène.Enfin, parmi d’autres réactions, on retiendra la formation de chlorure d’hydrogène par une réaction avec le méthane, CH4, ou l’hydrogène moléculaire, H2 ou d’autres constituants comme le formaldehyde, H2CO, le peroxyde d’hydrogène, H22. On observe par exemple la réaction:
Cette action se double en même temps de la formation de 2 qui donne lieu, comme nous l’avons déjà signalé, à la restitution d’atomes d’oxygène.Enfin, parmi d’autres réactions, on retiendra la formation de chlorure d’hydrogène par une réaction avec le méthane, CH4, ou l’hydrogène moléculaire, H2 ou d’autres constituants comme le formaldehyde, H2CO, le peroxyde d’hydrogène, H22. On observe par exemple la réaction: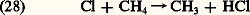 Mais HCl réagit avec OH, ce qui limite sa production effective dans la stratosphère:
Mais HCl réagit avec OH, ce qui limite sa production effective dans la stratosphère: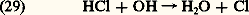 Il faut retenir que le chlorure d’hydrogène est le puits stratosphérique pour les composés chlorés, puisque ce composé pénètre, à partir de la tropopause, dans la troposphère où il disparaît, car il est soluble dans l’eau.On peut envisager la chimie atmosphérique du brome à peu près sous la même forme que celle du chlore, tandis que, dans le cas du fluor, la persistance de l’acide fluorhydrique, HF, ne réagissant pas avec l’hydroxyle limite la concentration de l’atome F et de son oxyde FO. L’acide fluorhydrique serait ainsi le puits stratosphérique du fluor avant de disparaître dans la troposphère.Les sources et les puits des composés hydrogénés, azotés et halogénésAlors que la troposphère se caractérise par une atmosphère où la concentration relative de la vapeur d’eau varie dans de très larges limites et peut atteindre des valeurs élevées (10 -5 à 10 -2), la stratosphère est une atmosphère desséchée où la concentration relative de la vapeur d’eau n’est que de quelques millionièmes. Il faut cependant introduire l’effet du méthane qui peut être oxydé par l’hydroxyle:
Il faut retenir que le chlorure d’hydrogène est le puits stratosphérique pour les composés chlorés, puisque ce composé pénètre, à partir de la tropopause, dans la troposphère où il disparaît, car il est soluble dans l’eau.On peut envisager la chimie atmosphérique du brome à peu près sous la même forme que celle du chlore, tandis que, dans le cas du fluor, la persistance de l’acide fluorhydrique, HF, ne réagissant pas avec l’hydroxyle limite la concentration de l’atome F et de son oxyde FO. L’acide fluorhydrique serait ainsi le puits stratosphérique du fluor avant de disparaître dans la troposphère.Les sources et les puits des composés hydrogénés, azotés et halogénésAlors que la troposphère se caractérise par une atmosphère où la concentration relative de la vapeur d’eau varie dans de très larges limites et peut atteindre des valeurs élevées (10 -5 à 10 -2), la stratosphère est une atmosphère desséchée où la concentration relative de la vapeur d’eau n’est que de quelques millionièmes. Il faut cependant introduire l’effet du méthane qui peut être oxydé par l’hydroxyle: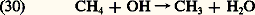 donnant lieu finalement à H2, H2O et à CO se transformant également par réaction avec OH en dioxyde de carbone:
donnant lieu finalement à H2, H2O et à CO se transformant également par réaction avec OH en dioxyde de carbone: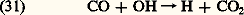 Dans la troposphère, la présence de OH due surtout à la réaction (9) est à la base de l’oxydation de nombreux constituants tels que les carbures d’hydrogène et de leurs dérivés comme le chlorure de méthyle, le chloroforme et les chlorofluorométhanes.Le méthane est un produit naturel qui provient de la décomposition de matières organiques sous certaines conditions; il apparaît comme gaz des marais, des terrains humides, des champs de riz et de la fermentation entérique animale, en particulier chez les ruminants. Diverses analyses conduisent aux résultats du tableau 1. Comme l’atmosphère contient quelque 4 gigatonnes (Gt) de méthane, on peut dire que le temps requis pour arriver à une telle masse n’est que de cinq à dix ans. La compensation destructrice, qui ne peut provenir que de la réaction (30), indique clairement la possibilité d’une influence humaine sur la concentration du méthane atmosphérique, par l’intermédiaire d’une activité microbienne.L’examen du cas des oxydes d’azote stratosphériques se ramène à considérer le problème de l’origine de l’hémioxyde d’azote. La source de 2O est aujourd’hui identifiée. Après sa fixation (atmosphérique, biologique ou artificielle: cf. tabl. 2), l’azote de l’air est transformé dans le sol en nitrates dont une partie donne lieu, par l’intermédiaire de bactéries dénitrifiantes, à des produits gazeux, 2 et 2O, qui s’échappent dans l’atmosphère. Comme la durée de vie de ce dernier composé est suffisamment longue dans la troposphère, il atteint la stratosphère où, avant d’être photodissocié en 2 et O, il réagit suivant le processus (13a ) pour produire le monoxyde d’azote.En adoptant une valeur de l’ordre de 5 p. 100 pour la proportion de 2O par rapport à 2, on voit que la quantité d’hémioxyde produite est de 10 à 15 mégatonnes (Mt) par an. Comme le contenu total de l’atmosphère en 2O est d’environ 1,5 Gt, il faut à peu près cent ans pour arriver à un tel total. On peut en conclure que la fixation industrielle de l’azote pourrait avoir un effet à longue échéance: depuis 1950, la quantité d’azote fixée n’a cessé d’augmenter et on va jusqu’à prévoir des quantités comprises entre 100 et 200 Mt par an vers l’an 2000. La fixation industrielle, qui atteint déjà aujourd’hui 25 p. 100 du total, pourrait ainsi perturber l’équilibre stratosphérique si elle augmentait au-delà de certaines limites.Dans le bilan des oxydes d’azote, on peut également penser à l’effet des vols stratosphériques qui introduisent directement le monoxyde d’azote dans la stratosphère. On doit cependant distinguer les avions subsoniques actuels et le Concorde volant au-dessous de 20 km des avions hypersoniques éventuels pouvant voler au-dessus de 25 km. Dans le premier cas, le mécanisme (24) conduit plutôt à une production d’ozone, alors que dans le second cas son effet est insuffisant et une destruction apparaît finalement.Les halocarbones, qui ne sont pas détruits dans la troposphère par des réactions chimiques avec l’hydroxyle, passent dans la stratosphère où ils sont photodissociés en libérant les atomes de chlore qui attaquent l’ozone. On reconnaît aujourd’hui un seul produit naturel, le chlorure de méthyle, CH3Cl, et des produits industriels, surtout le tétrachlorure de carbone, CCl4, le trichlorofluorométhane, CFCl3, et le dichlorodifluorométhane, C2Cl2. Le chlorure de méthyle, dont l’origine naturelle est marine, est certainement un constituant de la fumée lors de la combustion de produits chlorés (polyvinyle) ou de produits naturels résultant du brûlage des terres ou de l’essartage des forêts, surtout dans le cadre de l’agriculture tropicale liée à la culture sur brûlis. Tout fumeron conduit à la production de CH3Cl. Si l’on rapproche les productions industrielles et la dispersion dans l’atmosphère de C2Cl2, CFCl3 et CCl4, on obtient les résultats qui sont présentés dans le tableau 3.Le tétrachlorure de carbone, CCl4, est un composé en général utilisé pour la production d’autres produits tandis que les halocarbones 13 et 12 sont employés journellement dans les vaporisateurs (gaz propulseurs) et dans les réfrigérateurs. Comme la production annuelle de CFCl3 est passée de 1 000 t en 1947 à quelque 35 000 t en 1957, à environ 150 000 t en 1967 et dès 1989 à au moins 310 000 t, on conçoit que la production accumulée de chlore dans la stratosphère ne pourra pas rester sans effet sur l’ozone stratosphérique si la dispersion des halocarbones dans l’atmosphère ne cesse d’augmenter.
Dans la troposphère, la présence de OH due surtout à la réaction (9) est à la base de l’oxydation de nombreux constituants tels que les carbures d’hydrogène et de leurs dérivés comme le chlorure de méthyle, le chloroforme et les chlorofluorométhanes.Le méthane est un produit naturel qui provient de la décomposition de matières organiques sous certaines conditions; il apparaît comme gaz des marais, des terrains humides, des champs de riz et de la fermentation entérique animale, en particulier chez les ruminants. Diverses analyses conduisent aux résultats du tableau 1. Comme l’atmosphère contient quelque 4 gigatonnes (Gt) de méthane, on peut dire que le temps requis pour arriver à une telle masse n’est que de cinq à dix ans. La compensation destructrice, qui ne peut provenir que de la réaction (30), indique clairement la possibilité d’une influence humaine sur la concentration du méthane atmosphérique, par l’intermédiaire d’une activité microbienne.L’examen du cas des oxydes d’azote stratosphériques se ramène à considérer le problème de l’origine de l’hémioxyde d’azote. La source de 2O est aujourd’hui identifiée. Après sa fixation (atmosphérique, biologique ou artificielle: cf. tabl. 2), l’azote de l’air est transformé dans le sol en nitrates dont une partie donne lieu, par l’intermédiaire de bactéries dénitrifiantes, à des produits gazeux, 2 et 2O, qui s’échappent dans l’atmosphère. Comme la durée de vie de ce dernier composé est suffisamment longue dans la troposphère, il atteint la stratosphère où, avant d’être photodissocié en 2 et O, il réagit suivant le processus (13a ) pour produire le monoxyde d’azote.En adoptant une valeur de l’ordre de 5 p. 100 pour la proportion de 2O par rapport à 2, on voit que la quantité d’hémioxyde produite est de 10 à 15 mégatonnes (Mt) par an. Comme le contenu total de l’atmosphère en 2O est d’environ 1,5 Gt, il faut à peu près cent ans pour arriver à un tel total. On peut en conclure que la fixation industrielle de l’azote pourrait avoir un effet à longue échéance: depuis 1950, la quantité d’azote fixée n’a cessé d’augmenter et on va jusqu’à prévoir des quantités comprises entre 100 et 200 Mt par an vers l’an 2000. La fixation industrielle, qui atteint déjà aujourd’hui 25 p. 100 du total, pourrait ainsi perturber l’équilibre stratosphérique si elle augmentait au-delà de certaines limites.Dans le bilan des oxydes d’azote, on peut également penser à l’effet des vols stratosphériques qui introduisent directement le monoxyde d’azote dans la stratosphère. On doit cependant distinguer les avions subsoniques actuels et le Concorde volant au-dessous de 20 km des avions hypersoniques éventuels pouvant voler au-dessus de 25 km. Dans le premier cas, le mécanisme (24) conduit plutôt à une production d’ozone, alors que dans le second cas son effet est insuffisant et une destruction apparaît finalement.Les halocarbones, qui ne sont pas détruits dans la troposphère par des réactions chimiques avec l’hydroxyle, passent dans la stratosphère où ils sont photodissociés en libérant les atomes de chlore qui attaquent l’ozone. On reconnaît aujourd’hui un seul produit naturel, le chlorure de méthyle, CH3Cl, et des produits industriels, surtout le tétrachlorure de carbone, CCl4, le trichlorofluorométhane, CFCl3, et le dichlorodifluorométhane, C2Cl2. Le chlorure de méthyle, dont l’origine naturelle est marine, est certainement un constituant de la fumée lors de la combustion de produits chlorés (polyvinyle) ou de produits naturels résultant du brûlage des terres ou de l’essartage des forêts, surtout dans le cadre de l’agriculture tropicale liée à la culture sur brûlis. Tout fumeron conduit à la production de CH3Cl. Si l’on rapproche les productions industrielles et la dispersion dans l’atmosphère de C2Cl2, CFCl3 et CCl4, on obtient les résultats qui sont présentés dans le tableau 3.Le tétrachlorure de carbone, CCl4, est un composé en général utilisé pour la production d’autres produits tandis que les halocarbones 13 et 12 sont employés journellement dans les vaporisateurs (gaz propulseurs) et dans les réfrigérateurs. Comme la production annuelle de CFCl3 est passée de 1 000 t en 1947 à quelque 35 000 t en 1957, à environ 150 000 t en 1967 et dès 1989 à au moins 310 000 t, on conçoit que la production accumulée de chlore dans la stratosphère ne pourra pas rester sans effet sur l’ozone stratosphérique si la dispersion des halocarbones dans l’atmosphère ne cesse d’augmenter.
Encyclopédie Universelle. 2012.
